Notebooki, palmtopy i telefony komórkowe to przedmioty, bez których wielu ludzi nie wyobraża sobie już życia. U niektórych przechodzi to wręcz w uzależnienie. Pomijając aspekty społeczne i psychologiczne, fizyczną wadą tych urządzeń jest ograniczony czas pracy, a często również zbyt duża waga. Winę za to ponoszą z reguły "oszczędnie" zaprojektowane akumulatory, choć z drugiej strony okazuje się, że ich waga może dochodzić do 40 procent wagi całego urządzenia (Nokia 6210). Akumulator notebooka Dell Latitude D800 to 15 procent wagi całego komputera. Zależnie od typu akumulatora, czas pracy waha się od kilku dni w przypadku telefonów komórkowych do kilku godzin w przypadku notebooków.
Akumulatory oddają energię elektryczną w wyniku zachodzących w nich procesów chemicznych. Ich wydajność jest ograniczona objętością komórek i rodzajem zastosowanego procesu. W praktyce oznacza to, że akumulator może dostarczać prąd o określonych parametrach w skończonym czasie. Dobry akumulator powinien charakteryzować się następującymi cechami:
- długi czas pracy bez doładowania,
- mały ciężar,
- mała objętość,
- krótki czas ładowania,
- duża żywotność (liczba cykli ładowania/rozładowania),
- niska cena,
- łatwość utylizacji po zużyciu.
Opiszemy szczegółowo współczesne technologie akumulatorów ołowiowo-kwasowych, niklowo-kadmowych, niklowo-wodorkowych i litowo-polimerowych. Zajmiemy się też obiecującymi technologiami przyszłości - ogniwami paliwowymi i akumulatorami cynkowo-powietrznymi.
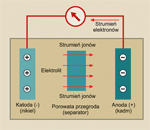
Sposób działania akumulatora
|
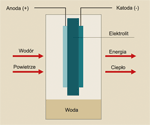
Akumulator działa w następujący sposób: w zbiorniku znajduje się ciecz przewodząca prąd elektryczny (elektrolit). W cieczy zanurzone są dwa elementy wykonane z różnych metali przewodzących (elektrody). Dzięki różnemu składowi chemicznemu powstaje między nimi napięcie. Tę właściwość metali odkrył w roku 1793 Alessandro Volta i zdefiniował ją w postaci "szeregu napięciowego Volty", mówiącej, że im bardziej dwa metale oddalone są od siebie w szeregu napięciowym, tym wyższe jest napięcie między nimi.
Aby możliwy był stały przepływ prądu, obwód musi być zamknięty również w elektrolicie. Zapewnia to proces elektrochemiczny w płynnym elektrolicie poprzez utlenianie i redukcję zastosowanych metali. Powstaje strumień jonów, płynących w elektrolicie przez separator od katody do anody. Jeżeli obwód prądu zostanie przerwany, "rozładowanie" zostaje przerwane, jakkolwiek niecałkowicie. Zależne od temperatury procesy chemiczne wewnątrz akumulatora powodują przepływ ładunków między elektrodami i rozładowują system. Zjawisko to nosi nazwę samorozładowania i w jego rezultacie akumulator zależnie od typu traci do 30 procent energii w ciągu miesiąca.
Ładowanie akumulatora polega na "wpompowaniu" elektronów od katody do anody i reaktywacji rozładowanych elektrod. Cykl ładowania i rozładowania można powtarzać do tysiąca razy zależnie od typu akumulatora, który później nie przetworzy już energii elektrycznej w chemiczną.
Historia akumulatorów
|
Około dziesięciu lat później Volta skonstruował pierwsze użyteczne ogniwo elektrochemiczne. Posłużył się paskami z miedzi i cynku, rozdzielonymi skórą nasączoną w solance.
Pierwowzór współczesnego akumulatora opracował w roku 1802 Johann Wilhelm Ritter. Znane dziś jako "kolumna Rittera" eksperymentalne urządzenie można było ładować prądem elektrycznym, odzyskiwanym podczas rozładowania. Szklana kolumna zawierała krążki z kartonu i miedzi, zalane roztworem soli kuchennej. Około roku 1850 naukowcy Sinsteden i Plante eksperymentowali z pierwszymi akumulatorami na bazie ołowiu, dwutlenku siarki i dwutlenku ołowiu. Zastosowane płyty ołowiane mogły po kilku cyklach ładowania i rozładowania - tak zwanym formowaniu - gromadzić energię elektryczną, aby później oddać ją do odbiornika. Pierwsze przemysłowe zastosowanie akumulatora opatentował Faure w roku 1880. Obłożył płytę ołowianą pastą z kwasu siarkowego i sproszkowanego ołowiu, uzyskując już w pierwszym ładowaniu bardzo dużą pojemność (wydajność energetyczną).
|
Rosnąca popularność urządzeń przenośnych i związane z tym zapotrzebowanie na lekkie, wydajne akumulatory o niewielkich wymiarach spowodowało, że w połowie lat dziewięćdziesiątych opracowano akumulatory litowe. Wraz z postępującą miniaturyzacją urządzeń producenci domagali się akumulatorów litowych o różnych kształtach. Tak powstały akumulatory litowo-polimerowe, które dziś stosowane są głównie w telefonach komórkowych i palmtopach.
Producenci akumulatorów pokładają wielkie nadzieje w ogniwie paliwowym
jako przyszłym wydajnym źródle energii. Podstawy tej technologii
opracował fizyk Robert Grove już w roku 1839, co więcej, zbudował nawet
działający prototyp. Były to dwie platynowe elektrody, umieszczone w
oddzielnych szklanych cylindrach. Grove napełnił jeden cylinder tlenem,
drugi wodorem i zanurzył je w rozcieńczonym kwasie siarkowym
(elektrolicie). W ten sposób powstało mierzalne napięcie, a konstrukcja
uznawana jest za pierwowzór ogniwa paliwowego. Technologia ogniw
paliwowych popadła na długie lata w zapomnienie. Dopiero w roku 1950
kompleks wojskowy i przemysł kosmiczny przypomniały sobie o istnieniu
tego wydajnego źródła energii. Od początku lat dziewięćdziesiątych
prowadzone są również badania nad komercyjnym wykorzystaniem ogniw
paliwowych - z dobrymi widokami na sukces.
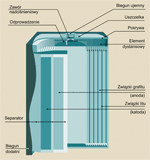
Akumulator ołowiowo-kwasowy
Dodatnia
elektroda tradycyjnego otwartego akumulatora ołowiowo-kwasowego jest
wykonana z dwutlenku ołowiu (PbO2), natomiast elektrodę ujemną tworzą
płyty ołowiane. Między płytami elektrod znajduje się separator, który
może być wykonany z włókna szklanego, struktury szklanej (microglas)
lub PCW. Elektrolit to odpowiednio rozcieńczony kwas siarkowy, od
pewnego czasu stosowany w postaci żelu, co zapobiega szybkiemu
odgazowaniu. Obudowa jest szczelnie zamkniętą skrzynką. Chroni to
akumulator przed szybkim "wyschnięciem" względnie odgazowaniem i
przedłuża jego żywotność, a ponadto upraszcza konserwację i zapobiega
wyciekom elektrolitu w razie nieprawidłowego obchodzenia się z nim
względnie przeciążenia mechanicznego lub elektrycznego. Stosuje się też
zabezpieczenie w postaci zaworu, który w przypadku nadmiernego wzrostu
ciśnienia w akumulatorze uwalnia nadmiar gazu.
Zalety akumulatorów ołowiowo-kwasowych to zdolność dostarczania dużych prądów oraz niskie koszty produkcji, gdyż stosowane są stosunkowo tanie materiały, jak ołów i kwas siarkowy. Również recykling nie stanowi większego problemu. Technologia nie jest obarczona takimi wadami, jak efekt pamięciowy czy efekt leniwego akumulatora. Wadą jest natomiast niska wartość energii właściwej, wynosząca około 30 do 50 Wh/kg (Wh - watogodziny). Możliwości stosowania tych akumulatorów ogranicza ich duża waga oraz spore wymiary. Stosowanie ołowiu jest również problematyczne z punktu widzenia ochrony środowiska.
Akumulatory ołowiowo-kwasowe stosowane są głównie w przemyśle samochodowym, a w informatyce - w zasilaczach bezprzerwowych (UPS). W obu tych przypadkach mogą, jak żadne inne, dostarczyć dużych prądów w krótkim czasie. Ich trwałość wynosi obecnie do sześciu lat, pod warunkiem przestrzegania zasad prawidłowej eksploatacji.
Akumulatory niklowo-kadmowe
Jak sugeruje nazwa, akumulator taki składa się z ujemnej elektrody kadmowej
oraz z dodatniej elektrody wykonanej z wodorotlenku niklu. Elektrolitem
jest wodorotlenek potasu. Renesans akumulatorów niklowo-kadmowych
nastąpił wraz z rozpowszechnieniem się notebooków. Mogą dostarczyć w
krótkim czasie duży prąd do prądożernych komponentów notebooka, jak
procesor, wyświetlacz i twardy dysk. Dodatkowo charakteryzują się dużą
trwałością przy niskich kosztach wytwarzania, bo podstawowe materiały -
nikiel i kadm - są stosunkowo niedrogie.
Wadą akumulatorów niklowo-kadmowych jest niewielka energia właściwa, rzędu 40 do 60 Wh/kg.
W akumulatorach niklowo-manganowych lub litowych jest ona dwa, a nawet trzy razy większa. Ponadto akumulatory niklowo-kadmowe charakteryzują się tzw. efektem pamięci.
Kadm stanowi wielki problem z punktu widzenia ochrony środowiska. To silnie toksyczny metal ciężki, wymagający stosowania gazoszczelnej obudowy i specjalnych procedur utylizacji. Ze względu na dużą obciążalność wykorzystuje się go przede wszystkim w urządzeniach o dużym poborze prądu. Z kolei niska cena powoduje, że jest chętnie stosowany na przykład w telefonach komórkowych i kamerach wideo.
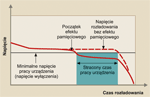
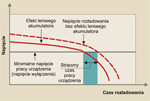
Efekt pamięciowy
Jedną z większych wad akumulatorów niklowo-kadmowych jest tzw. efekt
pamięciowy. Jego źródłem jest kadm zastosowany jako elektroda ujemna.
Metal ten w określonych warunkach ma tendencję do krystalizacji.
Zjawisko to występuje wówczas, gdy akumulator jest ponownie ładowany przed całkowitym rozładowaniem. W wyniku krystalizacji zmniejsza się pojemność, a od punktu wystąpienia efektu pamięciowego na linii rozładowania spada dostarczane napięcie. Akumulator nie dostarcza właściwego napięcia przez przewidziany czas i podłączone do niego urządzenie zwykle przedwcześnie się wyłącza na skutek spadku napięcia poniżej określonego poziomu. Efekt pamięciowy występuje również na skutek ładowania prądem niższym, niż przewidziany do danego typu akumulatora.
Efekt pamięciowy można usunąć poprzez wielokrotne rozładowanie przy niewielkim prądzie do ściśle określonego poziomu. Pomocne są specjalne ładowarki, wyposażone w funkcję Refreshing. Są sterowane mikroprocesorowo i mogą ustalić stan akumulatora, żeby następnie dobrać odpowiedni program ładowania, również do częściowo uszkodzonych akumulatorów. Taka procedura w zasadzie przywraca akumulator do pierwotnego stanu.
Akumulatory niklowo-metalowo-wodorkowe
Akumulatory niklowo-metalowo-wodorkowe (NiMH) to odpowiedź przemysłu na rosnące
zapotrzebowanie na akumulatory, które mogą dostarczać dużych,
stabilnych prądów przez długi czas. Elektrody umieszczone są w
elektrolicie o odczynie alkalicznym. Biegun dodatni jest wykonany z
wodorotlenku niklu, a biegun ujemny to stop metalu, który może wiązać
wodór. Budowa gazoszczelnych akumulatorów NiMH jest taka sama, jak
akumulatorów niklowo-kadmowych.
Dzięki zastosowanym materiałom akumulator NiMH dostarcza przy tej samej objętości i wadze wyższą energię właściwą, niż niklowo-kadmowy - od 60 do 80 Wh/kg. W tej technologii nie jest stosowany toksyczny kadm, a więc utylizacja zużytych akumulatorów nastręcza mniej problemów. Istotną wadą NiMH jest efekt leniwego akumulatora - podobny do efektu pamięciowego akumulatorów niklowo-kadmowych. Ze względu na niewielką szkodliwość dla środowiska oraz dużą pojemność akumulatory NiMH stosowane są przede wszystkim w telefonach komórkowych, kamerach wideo, notebookach i urządzeniach audio.
Efekt leniwego akumulatora
Odwracalny efekt leniwego akumulatora (lazy battery effect) jest porównywalny z
efektem pamięciowym akumulatorów niklowo-kadmowych. Powstaje w wyniku
niecałkowitego rozładowania akumulatora w trakcie pracy lub
długotrwałego ładowania prądem o za małym natężeniu (niezgodnym ze
specyfikacją). Podobnie jak w przypadku efektu pamięciowego, na
dodatniej elektrodzie wykonanej z wodorotlenku niklu tworzą się
kryształy. Jednak napięcie obniża się nieznacznie w całym okresie
rozładowania, a nie dopiero po częściowym rozładowaniu akumulatora.
Skutki efektu leniwego akumulatora są mniejsze niż efektu pamięciowego. Napięcie jest wprawdzie nieco niższe od znamionowego, ale czas pracy urządzenia skraca się nieznacznie. Aby usunąć efekt, należy kolejno dwu- lub trzykrotnie całkowicie rozładować akumulator. Podobnie jak w przypadku efektu pamięciowego, specjalna ładowarka przywróci pierwotny stan akumulatora.
Akumulator ołowiowo-kwasowy
|
Zalety akumulatorów ołowiowo-kwasowych to zdolność dostarczania dużych prądów oraz niskie koszty produkcji, gdyż stosowane są stosunkowo tanie materiały, jak ołów i kwas siarkowy. Również recykling nie stanowi większego problemu. Technologia nie jest obarczona takimi wadami, jak efekt pamięciowy czy efekt leniwego akumulatora. Wadą jest natomiast niska wartość energii właściwej, wynosząca około 30 do 50 Wh/kg (Wh - watogodziny). Możliwości stosowania tych akumulatorów ogranicza ich duża waga oraz spore wymiary. Stosowanie ołowiu jest również problematyczne z punktu widzenia ochrony środowiska.
Akumulatory ołowiowo-kwasowe stosowane są głównie w przemyśle samochodowym, a w informatyce - w zasilaczach bezprzerwowych (UPS). W obu tych przypadkach mogą, jak żadne inne, dostarczyć dużych prądów w krótkim czasie. Ich trwałość wynosi obecnie do sześciu lat, pod warunkiem przestrzegania zasad prawidłowej eksploatacji.
Akumulatory niklowo-kadmowe
|
Wadą akumulatorów niklowo-kadmowych jest niewielka energia właściwa, rzędu 40 do 60 Wh/kg.
W akumulatorach niklowo-manganowych lub litowych jest ona dwa, a nawet trzy razy większa. Ponadto akumulatory niklowo-kadmowe charakteryzują się tzw. efektem pamięci.
Kadm stanowi wielki problem z punktu widzenia ochrony środowiska. To silnie toksyczny metal ciężki, wymagający stosowania gazoszczelnej obudowy i specjalnych procedur utylizacji. Ze względu na dużą obciążalność wykorzystuje się go przede wszystkim w urządzeniach o dużym poborze prądu. Z kolei niska cena powoduje, że jest chętnie stosowany na przykład w telefonach komórkowych i kamerach wideo.
Efekt pamięciowy
|
Zjawisko to występuje wówczas, gdy akumulator jest ponownie ładowany przed całkowitym rozładowaniem. W wyniku krystalizacji zmniejsza się pojemność, a od punktu wystąpienia efektu pamięciowego na linii rozładowania spada dostarczane napięcie. Akumulator nie dostarcza właściwego napięcia przez przewidziany czas i podłączone do niego urządzenie zwykle przedwcześnie się wyłącza na skutek spadku napięcia poniżej określonego poziomu. Efekt pamięciowy występuje również na skutek ładowania prądem niższym, niż przewidziany do danego typu akumulatora.
Efekt pamięciowy można usunąć poprzez wielokrotne rozładowanie przy niewielkim prądzie do ściśle określonego poziomu. Pomocne są specjalne ładowarki, wyposażone w funkcję Refreshing. Są sterowane mikroprocesorowo i mogą ustalić stan akumulatora, żeby następnie dobrać odpowiedni program ładowania, również do częściowo uszkodzonych akumulatorów. Taka procedura w zasadzie przywraca akumulator do pierwotnego stanu.
Akumulatory niklowo-metalowo-wodorkowe
|
Dzięki zastosowanym materiałom akumulator NiMH dostarcza przy tej samej objętości i wadze wyższą energię właściwą, niż niklowo-kadmowy - od 60 do 80 Wh/kg. W tej technologii nie jest stosowany toksyczny kadm, a więc utylizacja zużytych akumulatorów nastręcza mniej problemów. Istotną wadą NiMH jest efekt leniwego akumulatora - podobny do efektu pamięciowego akumulatorów niklowo-kadmowych. Ze względu na niewielką szkodliwość dla środowiska oraz dużą pojemność akumulatory NiMH stosowane są przede wszystkim w telefonach komórkowych, kamerach wideo, notebookach i urządzeniach audio.
Efekt leniwego akumulatora
|
Skutki efektu leniwego akumulatora są mniejsze niż efektu pamięciowego. Napięcie jest wprawdzie nieco niższe od znamionowego, ale czas pracy urządzenia skraca się nieznacznie. Aby usunąć efekt, należy kolejno dwu- lub trzykrotnie całkowicie rozładować akumulator. Podobnie jak w przypadku efektu pamięciowego, specjalna ładowarka przywróci pierwotny stan akumulatora.
Akumulatory litowe
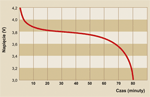
Akumulatory litowe to najnowsze osiągnięcie technologii akumulatorów. Charakteryzuje się najwyższą energią właściwą, rzędu 90-110 Wh/kg. Dodatkowa zaleta to niewielkie samorozładowania, a więc długi czas przechowywania bez ponownego ładowania. Jednak szczególną zaletą akumulatorów Li-Io jest to, że nie dotyczy ich ani efekt pamięciowy, ani efekt leniwego akumulatora. Dostarczają niemal stałego napięcia (ponad 3,6 V) w całym okresie rozładowania.
Odmienie niż akumulatory NiCd czy NiMH, akumulator Li-Io wytwarza napięcie 3,6 V zamiast 1,2 V. Wynika to z jego budowy. Elektroda ujemna jest wykonana ze związków litu, które mogą zawierać tlenek kobaltu, manganu lub niklu, natomiast anoda - ze związków grafitu. Separator między membranami stanowi mikroprzepuszczalna membrana z tworzywa sztucznego. Elektrolit to ciecz organiczna zawierająca sól litu.
Lit to silnie reagujący metal lekki, a więc mocno nagrzany łatwopalny materiał mógłby eksplodować.
Z tego powodu obecnie produkowane akumulatory zawierają organiczny elektrolit. Mimo to każdy akumulator litowy jest wyposażony w zawór bezpieczeństwa i ma szczególnie solidną obudowę. Dodatkowo każdy zawiera specjalne układy elektroniczne, nadzorujące przebieg ładowania - chronią przed powstaniem zbyt dużych prądów ładowania i rozładowania, nadzorują warunki ładowania i rozładowania oraz zabezpieczają akumulator przed przegrzaniem. Oczywiście, wszystkie te zabezpieczenia mają wpływ na cenę akumulatora. Akumulator Li-Io jest o prawie 30 procent droższy od akumulatora NiMH.
Akumulatory Li-Io mają najwyższą zdolność gromadzenia energii w przeliczeniu na wagę i objętość, jednak nie osiągają dużej pojemności. Najczęściej stosowane są w telefonach komórkowych, kamerach cyfrowych i notebookach.
Akumulatory litowo-polimerowe
Akumulatory litowo-polimerowe charakteryzują się zasadniczo taką samą budową, jak
akumulatory litowe, ale nie zawierają ciekłego elektrolitu, a więc
niebezpieczeństwo wycieku jest mniejsze. Elektrolit może mieć postać
żelu lub wręcz stałą, mimo to akumulator litowo-polimerowy
charakteryzuje się taką samą energią właściwą, jak litowy.
Obudowy akumulatorów litowo-polimerowych mogą mieć kształty nie tylko klasycznego pudełka lub cylindryczne. Zewnętrzna powłoka z aluminiowej lub metalizowanej folii pozwala niemal dowolnie kształtować akumulator, który może wypełnić "opakowanie" o skomplikowanych kształtach.
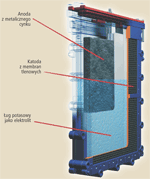
Akumulatory cynkowo-powietrzne
Prace rozwojowe nad akumulatorami cynkowo-powietrznymi są jeszcze w
powijakach, ale sama technologia wcale nie jest nowa. Akumulator taki
składa się z ujemnej elektrody cynkowej oraz dodatniej elektrody z
aktywnego węgla. Elektroda ujemna ma postać mechanicznie sprasowanej
gąbki lub proszku cynkowego. Duża powierzchnia gwarantuje optymalny
przebieg reakcji chemicznej dzięki łatwemu uwalnianiu elektronów.
Aktywnym składnikiem reakcji chemicznej po stronie bieguna dodatniego
jest tlen z powietrza, dlatego elektroda dodatnia jest wykonana ze
specjalnego węgla (węgiel aktywny w postaci membran tlenowych), który
absorbuje z powietrza tlen potrzebny do reakcji chemicznej. Zależnie od
przeznaczenia i budowy akumulatora elektrolitem może być ług potasowy w
postaci cieczy lub pasty. Wszystkie zastosowane materiały są
nieszkodliwe dla środowiska lub dają się łatwo utylizować, w dodatku są
tanie.
Wadą akumulatora cynkowo-powietrznego jest to, że tworzy otwarty system chemiczny. Podczas rozładowania powierzchnia, na której zachodzi reakcja, musi mieć zapewniony dopływ powietrza z otoczenia, a podczas ładowania trzeba odprowadzać uwolniony tlen. Jest oczywiste, że akumulator nie może być stosowany w pomieszczeniach zamkniętych.
Jego zaletą jest bardzo małe samorozładowanie w stanie zamkniętym, to znaczy bez dostępu powietrza. Bez elektrolitu można go przechowywać dziesięć lat. Pojemność elektryczna jest bardzo duża i wynosi nawet trzykrotność porównywalnego akumulatora litowego. Nie występują żadne niekorzystne zjawiska, jak efekt pamięciowy czy efekt leniwego akumulatora.
Duża energia właściwa, rzędu 350 Wh/kg sprawia, że jednorazowych ogniw cynkowo-powietrznych używa się przede wszystkim w aparatach słuchowych i urządzeniach przywoławczych. Jako baterie akumulatorów stosowane są stacjonarnych urządzeniach typu UPS. Prototypy do urządzeń przenośnych, jak notebooki, znajdują się w fazie opracowania. Trudno w tej chwili przewidzieć, kiedy rozpocznie się produkcja seryjna.
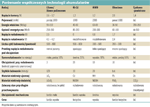
Porównanie parametrów współczesnych akumulatorów
Parametry opisywanych typów akumulatorów zebraliśmy w postaci tabeli. Podajemy typowe wartości akumulatora porównywalnego z baterią AA oraz przypominamy wady i zalety poszczególnych technologii.
Przechowywanie i konserwacja akumulatorów
Nawet jeżeli naładowany akumulator nie jest używany przez dłuższy czas, procesy chemiczne w jego komorach zachodzą stale i tzw. samorozładowanie powoduje, że po upływie tygodni lub miesięcy tracą zgromadzony ładunek energii.
Samorozładowanie przebiega szybciej w podwyższonej temperaturze. Aby mu przeciwdziałać,
należy przechowywać akumulator w suchym i chłodnym miejscu.
Doładowywanie go w pewnych odstępach czasu zapobiega głębokiemu
rozładowaniu i przedłuża jego żywotność.
Odpowiednie ładowanie przedłuża trwałość i przydatność akumulatora. Nowoczesna, sterowana mikroprocesorowo ładowarka może uwzględniać wiele parametrów fizycznych akumulatora (prąd, napięcie, temperatura), odpowiednio dostosowując parametry ładowania. W ten sposób akumulator jest zawsze ładowany optymalnym prądem i napięciem. Co najważniejsze, inteligentna ładowarka "wie", kiedy zakończyć ładowanie. Przechodzi wówczas w tryb okresowego doładowywania, podtrzymującego pełną gotowość akumulatora do pracy. Kolejne zalety profesjonalnych ładowarek to programy regeneracji i konserwacji akumulatorów. Składają się na nie specjalne cykle ładowania i rozładowania o ściśle określonych parametrach elektrycznych. W rezultacie czas pracy akumulatora znacznie się wydłuża, ponadto zachowuje on niemal przez cały okres eksploatacji swoją pojemność znamionową - czyli zdolność nowego akumulatora do gromadzenia określonej ilości energii elektrycznej.
Ogniwo paliwowe
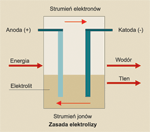
W porównaniu z klasycznymi technologiami akumulatorów NiCd, NiMH i Li-Io technologia ogniw paliwowych ma największy potencjał rozwojowy w zakresie dostarczania energii do urządzeń przenośnych. Ogniwo paliwowe opiera się na odwróconym procesie elektrolizy, który przy użyciu prądu elektrycznego rozkłada wodę na wodór i tlen. Tak uzyskany wodór służy jako źródło energii w procesach spalania (efekt gwałtownego spalania gazu).
Ogniwo paliwowe korzysta z tlenu atmosferycznego i wodoru jako źródeł energii. W trakcie reakcji chemicznej, tzw. zimnego spalania, przekształca oba pierwiastki w energię elektryczną. Produkty odpadowe to ciepło i woda. W ten sposób powstaje dwukrotnie więcej energii niż w klasycznym procesie spalania.
Budowa ogniwa paliwowego jest prosta. Najważniejszy element to półprzepuszczalna dla elektrolitu membrana wykonana z materiału na bazie polimeru. Przepuszcza jedynie protony wodoru, zapobiegając łączeniu się wodoru i tlenu w wodę. Elektrody - anoda i katoda - są katalizatorami odpowiednio wodoru i tlenu z powietrza.
Akumulatory litowe to najnowsze osiągnięcie technologii akumulatorów. Charakteryzuje się najwyższą energią właściwą, rzędu 90-110 Wh/kg. Dodatkowa zaleta to niewielkie samorozładowania, a więc długi czas przechowywania bez ponownego ładowania. Jednak szczególną zaletą akumulatorów Li-Io jest to, że nie dotyczy ich ani efekt pamięciowy, ani efekt leniwego akumulatora. Dostarczają niemal stałego napięcia (ponad 3,6 V) w całym okresie rozładowania.
Odmienie niż akumulatory NiCd czy NiMH, akumulator Li-Io wytwarza napięcie 3,6 V zamiast 1,2 V. Wynika to z jego budowy. Elektroda ujemna jest wykonana ze związków litu, które mogą zawierać tlenek kobaltu, manganu lub niklu, natomiast anoda - ze związków grafitu. Separator między membranami stanowi mikroprzepuszczalna membrana z tworzywa sztucznego. Elektrolit to ciecz organiczna zawierająca sól litu.
Lit to silnie reagujący metal lekki, a więc mocno nagrzany łatwopalny materiał mógłby eksplodować.
Z tego powodu obecnie produkowane akumulatory zawierają organiczny elektrolit. Mimo to każdy akumulator litowy jest wyposażony w zawór bezpieczeństwa i ma szczególnie solidną obudowę. Dodatkowo każdy zawiera specjalne układy elektroniczne, nadzorujące przebieg ładowania - chronią przed powstaniem zbyt dużych prądów ładowania i rozładowania, nadzorują warunki ładowania i rozładowania oraz zabezpieczają akumulator przed przegrzaniem. Oczywiście, wszystkie te zabezpieczenia mają wpływ na cenę akumulatora. Akumulator Li-Io jest o prawie 30 procent droższy od akumulatora NiMH.
Akumulatory Li-Io mają najwyższą zdolność gromadzenia energii w przeliczeniu na wagę i objętość, jednak nie osiągają dużej pojemności. Najczęściej stosowane są w telefonach komórkowych, kamerach cyfrowych i notebookach.
Akumulatory litowo-polimerowe
|
Obudowy akumulatorów litowo-polimerowych mogą mieć kształty nie tylko klasycznego pudełka lub cylindryczne. Zewnętrzna powłoka z aluminiowej lub metalizowanej folii pozwala niemal dowolnie kształtować akumulator, który może wypełnić "opakowanie" o skomplikowanych kształtach.
Akumulatory cynkowo-powietrzne
|
Wadą akumulatora cynkowo-powietrznego jest to, że tworzy otwarty system chemiczny. Podczas rozładowania powierzchnia, na której zachodzi reakcja, musi mieć zapewniony dopływ powietrza z otoczenia, a podczas ładowania trzeba odprowadzać uwolniony tlen. Jest oczywiste, że akumulator nie może być stosowany w pomieszczeniach zamkniętych.
Jego zaletą jest bardzo małe samorozładowanie w stanie zamkniętym, to znaczy bez dostępu powietrza. Bez elektrolitu można go przechowywać dziesięć lat. Pojemność elektryczna jest bardzo duża i wynosi nawet trzykrotność porównywalnego akumulatora litowego. Nie występują żadne niekorzystne zjawiska, jak efekt pamięciowy czy efekt leniwego akumulatora.
Duża energia właściwa, rzędu 350 Wh/kg sprawia, że jednorazowych ogniw cynkowo-powietrznych używa się przede wszystkim w aparatach słuchowych i urządzeniach przywoławczych. Jako baterie akumulatorów stosowane są stacjonarnych urządzeniach typu UPS. Prototypy do urządzeń przenośnych, jak notebooki, znajdują się w fazie opracowania. Trudno w tej chwili przewidzieć, kiedy rozpocznie się produkcja seryjna.
Porównanie parametrów współczesnych akumulatorów
Parametry opisywanych typów akumulatorów zebraliśmy w postaci tabeli. Podajemy typowe wartości akumulatora porównywalnego z baterią AA oraz przypominamy wady i zalety poszczególnych technologii.
Przechowywanie i konserwacja akumulatorów
Nawet jeżeli naładowany akumulator nie jest używany przez dłuższy czas, procesy chemiczne w jego komorach zachodzą stale i tzw. samorozładowanie powoduje, że po upływie tygodni lub miesięcy tracą zgromadzony ładunek energii.
|
Odpowiednie ładowanie przedłuża trwałość i przydatność akumulatora. Nowoczesna, sterowana mikroprocesorowo ładowarka może uwzględniać wiele parametrów fizycznych akumulatora (prąd, napięcie, temperatura), odpowiednio dostosowując parametry ładowania. W ten sposób akumulator jest zawsze ładowany optymalnym prądem i napięciem. Co najważniejsze, inteligentna ładowarka "wie", kiedy zakończyć ładowanie. Przechodzi wówczas w tryb okresowego doładowywania, podtrzymującego pełną gotowość akumulatora do pracy. Kolejne zalety profesjonalnych ładowarek to programy regeneracji i konserwacji akumulatorów. Składają się na nie specjalne cykle ładowania i rozładowania o ściśle określonych parametrach elektrycznych. W rezultacie czas pracy akumulatora znacznie się wydłuża, ponadto zachowuje on niemal przez cały okres eksploatacji swoją pojemność znamionową - czyli zdolność nowego akumulatora do gromadzenia określonej ilości energii elektrycznej.
Ogniwo paliwowe
W porównaniu z klasycznymi technologiami akumulatorów NiCd, NiMH i Li-Io technologia ogniw paliwowych ma największy potencjał rozwojowy w zakresie dostarczania energii do urządzeń przenośnych. Ogniwo paliwowe opiera się na odwróconym procesie elektrolizy, który przy użyciu prądu elektrycznego rozkłada wodę na wodór i tlen. Tak uzyskany wodór służy jako źródło energii w procesach spalania (efekt gwałtownego spalania gazu).
Ogniwo paliwowe korzysta z tlenu atmosferycznego i wodoru jako źródeł energii. W trakcie reakcji chemicznej, tzw. zimnego spalania, przekształca oba pierwiastki w energię elektryczną. Produkty odpadowe to ciepło i woda. W ten sposób powstaje dwukrotnie więcej energii niż w klasycznym procesie spalania.
Budowa ogniwa paliwowego jest prosta. Najważniejszy element to półprzepuszczalna dla elektrolitu membrana wykonana z materiału na bazie polimeru. Przepuszcza jedynie protony wodoru, zapobiegając łączeniu się wodoru i tlenu w wodę. Elektrody - anoda i katoda - są katalizatorami odpowiednio wodoru i tlenu z powietrza.
Proces zimnego spalania przebiega w następujący sposób. W katodzie
ogniwa paliwowego znajduje się tlen, zaś w anodzie wodór. Membrana
polimerowa rozdziela wodór na elektrony i jony (naładowane jądra
atomowe). Jony wodoru przenikają przez membranę i próbują utleniać się
z wodorem, tworząc wodę. Do tego brak jednak znajdujących się po
stronie wodoru elektronów, które oddzielone są membraną od strony
tlenu.
Gdy połączy się anodę i katodę ogniwa paliwowego, popłynie użyteczny prąd, który wyrówna poziom elektronów. Proces elektrochemiczny w ogniwie paliwowym przebiega aż do zużycia czynników reakcji.
Zalety technologii ogniw paliwowych to wysoka efektywność i duża gęstość energetyczna w porównaniu z tradycyjnymi systemami. Wadą jest mała wydajność prądowa ogniwa. Stosowane obecnie w urządzeniach przenośnych prototypowe ogniwa paliwowe wciąż wymagają bufora w postaci tradycyjnych akumulatorów, które mogą okresowo zapewnić wysoką wydajność prądową. W takim układzie jedynym zadaniem ogniwa paliwowego jest ciągłe doładowywanie akumulatora.
Działające prototypy ogniw paliwowych do notebooków przedstawiały w latach 2000-2003 m.in Motorola, NEC i Toshiba. Pierwsze wersje handlowe zapowiadane są na rok 2004, jednak do tej pory się nie pojawiły.
Podsumowanie
Tradycyjne technologie akumulatorów NiCd i NiMH osiągnęły praktycznie kres swoich
możliwości. Ze względu na zawartość toksycznych metali i niską energię
właściwą akumulatory niklowo-kadmowe nie odgrywają żadnej roli w
segmencie mobilnym. Ich niszowe zastosowanie to urządzenia wymagające
krótkotrwałych, dużych prądów - prąd rozładowania akumulatora Ni-Cd
może dwudziestokrotnie przekraczać jego pojemność znamionową.
Akumulatory niklowo-metalowo-wodorkowe zaliczają się obecnie do najpopularniejszych źródeł energii wielokrotnego użytku. Dysponują dużą energią właściwą, pojemnością i obciążalnością. Dodatkowo stanowią mniejsze obciążenie dla środowiska, gdyż toksyczny kadm zastąpiono wodorkiem metalu. Ich wady to mała żywotność (liczba cykli ładowania/rozładowania) oraz wysokie samorozładowanie.
Duże możliwości rozwoju są jeszcze przed akumulatorami litowymi i
litowo-polimerowymi. Mają dużą energię właściwą, niskie
samorozładowanie i nie podlegają wadom w rodzaju efektu pamięciowego czy
efektu leniwego akumulatora. Akumulator litowo-polimerowy daje się
niemal dowolnie formować, co zwiększa możliwości zastosowania. Zalety
mają swoją cenę - za wygodę użytkownik musi dopłacić.
W przyszłości źródłami energii do urządzeń przenośnych mogą być akumulatory cynkowo-powietrzne i ogniwa paliwowe. Obecnie wciąż trwają prace badawcze, ale perspektywy są bardzo obiecujące.
Akumulator ołowiowo-kwasowy to jedno z najstarszych i najbardziej rozpowszechnione źródło energii. Jako zapasowe źródło energii w zasilaczach bezprzerwowych (UPS) lub jako akumulator rozruchowy, oferuje niezrównany stosunek osiągów do ceny, wynikający z zastosowania powszechnie występującego i taniego ołowiu. Dodatkowo, dzięki zastosowaniu nowoczesnych rozwiązań, jest niekłopotliwy w eksploatacji. Z wad należy wymienić bardzo niską gęstość energetyczną w porównaniu z innymi technologiami oraz uciążliwość ołowiu dla środowiska.
źródło: http://cyfrowydom.idg.pl/artykuly/44629_0.html
Gdy połączy się anodę i katodę ogniwa paliwowego, popłynie użyteczny prąd, który wyrówna poziom elektronów. Proces elektrochemiczny w ogniwie paliwowym przebiega aż do zużycia czynników reakcji.
Zalety technologii ogniw paliwowych to wysoka efektywność i duża gęstość energetyczna w porównaniu z tradycyjnymi systemami. Wadą jest mała wydajność prądowa ogniwa. Stosowane obecnie w urządzeniach przenośnych prototypowe ogniwa paliwowe wciąż wymagają bufora w postaci tradycyjnych akumulatorów, które mogą okresowo zapewnić wysoką wydajność prądową. W takim układzie jedynym zadaniem ogniwa paliwowego jest ciągłe doładowywanie akumulatora.
Działające prototypy ogniw paliwowych do notebooków przedstawiały w latach 2000-2003 m.in Motorola, NEC i Toshiba. Pierwsze wersje handlowe zapowiadane są na rok 2004, jednak do tej pory się nie pojawiły.
Podsumowanie
|
Akumulatory niklowo-metalowo-wodorkowe zaliczają się obecnie do najpopularniejszych źródeł energii wielokrotnego użytku. Dysponują dużą energią właściwą, pojemnością i obciążalnością. Dodatkowo stanowią mniejsze obciążenie dla środowiska, gdyż toksyczny kadm zastąpiono wodorkiem metalu. Ich wady to mała żywotność (liczba cykli ładowania/rozładowania) oraz wysokie samorozładowanie.
|
W przyszłości źródłami energii do urządzeń przenośnych mogą być akumulatory cynkowo-powietrzne i ogniwa paliwowe. Obecnie wciąż trwają prace badawcze, ale perspektywy są bardzo obiecujące.
Akumulator ołowiowo-kwasowy to jedno z najstarszych i najbardziej rozpowszechnione źródło energii. Jako zapasowe źródło energii w zasilaczach bezprzerwowych (UPS) lub jako akumulator rozruchowy, oferuje niezrównany stosunek osiągów do ceny, wynikający z zastosowania powszechnie występującego i taniego ołowiu. Dodatkowo, dzięki zastosowaniu nowoczesnych rozwiązań, jest niekłopotliwy w eksploatacji. Z wad należy wymienić bardzo niską gęstość energetyczną w porównaniu z innymi technologiami oraz uciążliwość ołowiu dla środowiska.
źródło: http://cyfrowydom.idg.pl/artykuly/44629_0.html
1 października 2004